
T7体外转录试剂盒是一种使用T7 RNA聚合酶,以带有T7启动子的DNA为模板,通过体外转录合成RNA的试剂盒, 适用于长链和短链转录模版。本品提供的 T7 Enzyme Mix中已经预混了RNase抑制剂与无机焦磷酸酶。DNase I, RNase-free用于转录反应结束后消解模板DNA。使用本品以1μg线性化双链DNA模板可以转录获得至少200μg以上的RNA。通过转录合成的RNA可用于多种下游应用, 如体外翻译、RNA结构和功能研究、RNase保护、探针杂交、RNA干扰等。
【基本信息】
货号 | GC070103408 |
规格 | 50次 |
储存条件 | -20 ℃保存,有效期1年,不可长时间室温放置。 |
【试剂盒内容】
T7聚合酶预混液 | 100uL |
10×T7聚合酶预混液 Buffer | 100uL |
ATP(100mM) | 100uL |
UTP(100mM) | 100uL |
CTP(100mM) | 100uL |
GTP(100mM) | 100uL |
对照模版 | 20uL |
DNase I(1U/uL) | 100uL |
DEPC 水(RNase free) | 1000uL |
【转录原理】
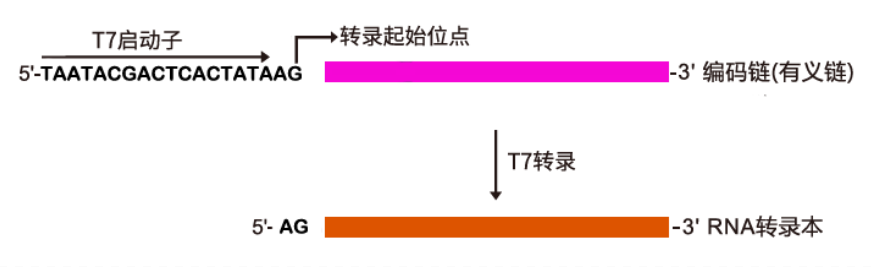
【转录原理】
1. DNA 模板制备带有T7启动子的线性化质粒或PCR扩增产物都可以作为体外转录模板,模板可以用TE缓冲液或Nuclease-Free Water溶解。 T7启动子序列:TAATACGACTCACTATA
注:RNA 转录的第一个碱基,一般为G,若进行共转录由帽子类似物决定。本试剂盒展示原理为Cap1加帽原理。
(1)质粒模板 将目的DNA插入含有T7启动子的质粒载体中,然后用限制酶进行处理,待完全线性化后进行纯化。
注1:由于终止子不能保证转录100%终止,环状质粒会转录出不同长度的RNA产物。 为了得到特定长度的 RNA,质粒必须完全线性化。 注2:质粒线性化所选限制酶的酶切位点需要紧邻编码链下游,且在编码链中无识 别位点。选择的限制酶要能形成5'突出末端或者平滑末端。 注3:为了避免蛋白及盐离子等对转录体系的影响,线性化质粒建议纯化后再作为 模板进行体外转录。 注4:质粒DNA抽提过程中引入的RNase A残留会显著影响转录RNA的质量,建 议使用A260/A280为1.8~2.0的高纯度RNase-free模板。
(2)PCR产物模板 带 T7 启动子的PCR产物可以作为体外转录模板。首先将T7启动 子序列加在编码链上游引物的5'端,然后在高保真酶的作用下扩增含T7 启动子的DNA模板,随后进行转录。PCR产物可以不经纯化直接作为 模板, 但纯化后RNA收率会更高。
注1:PCR产物作为模板,必须电泳确认产物的特异性及浓度,建议20 μl反应体 系投入2~5 μl PCR产物。 注2:为了得到更多高品质的RNA,推荐PCR产物纯化之后再作为模板进行体外转录。
2. 体外转录
(1)根据所需产物类型选择下面三个反应体系进行反应溶液加样。
①标准体外转录体系在冰上配制如下反应体系:
试剂 | 体积 uL | 终浓度 |
T7聚合酶预混液 | 2 | 1× |
10×T7聚合酶预混液 Buffer | 2 | - |
DNA模版 | 1ug | 20ng/uL |
ATP/UTP/CTP/GTP(100mM) | 2 | 10nM each |
DEPC水 | 补满20 |
②加帽RNA共转录体系 在冰上配制如下反应体系:
试剂 | 体积 uL | 终浓度 |
T7聚合酶预混液 | 2 | 1× |
10×T7聚合酶预混液 Buffer | 2 | - |
DNA模版 | 1ug | 20ng/uL |
ATP/UTP/CTP/GTP(100mM) | 2 | 10nM each |
Cap1类似物100mM | 1.6 | |
DEPC水 | 补满20 |
注:帽子类似物与每种 NTP 的摩尔浓度之比应为 4 : 5,该摩尔比适用于 CleanCap 系列帽子类似物。若使用其它结构的帽子类似物,请根据帽子类似物的说明书设定帽子类似物与GTP的合理比例,可根据加帽效率调整比例,但两者终浓度之和控制在10 mM 为宜。
③非放射性标记RNA体外转录体系
试剂 | 体积 uL | 终浓度 |
T7聚合酶预混液 | 2 | 1× |
10×T7聚合酶预混液 Buffer | 2 | - |
DNA模版 | 1ug | 20ng/uL |
ATP/CTP/GTP(100mM) | 2 | 10nM each |
UTP(100mM) | 1.5 | |
修饰UTP(50mM) | 1 | |
DEPC水 | 补满20 |
注:本体系适用生物素修饰UTP、荧光素修饰UTP、地高辛修饰UTP或者氨基烯丙基修饰UTP,使用修饰UTP转录产量会比未修饰UTP转录产量偏低。 注1:不同模板序列的转录效率差异较大,初次实验可先按照建议加入量进行,然后再摸索优化最适体系, 模板量可在 0.5 μg~2 μg 的范围进行调整。
(2)充分混匀并瞬离后,37℃温育2 h。若转录产物长度<100 nt,可延长反应时间至3~16 h。
(3)反应结束后,向产物中按照每μg Template DNA加入2 μl DNase I, RNase-free 的比例,37℃孵育15 min以去除 DNA 模板。
(4)转录后的RNA推荐用磁珠或者柱纯化,也可以采用酚/氯仿或者氯化锂纯化。纯化后的RNA可以进行下游实验或者储存于-80℃备用。
3. 对照模板转录
对照模板是一个含有T7启动子的线性DNA片段,转录产物大小约4000 nt。在推荐的标准体外转录反应体系中,1 μg对照模板DNA在37℃下反应2 h至少可获得200 μg以上的RNA。
(2)4.产物纯化
转录后的 RNA 可以选用磁珠法进行纯化,也可以采用柱纯化、酚 / 氯仿纯化法或氯化锂沉淀法等,以去除蛋白、游离的核苷酸。纯化后的 RNA 经电泳检测后可进行下游实验或存储于-80℃。
(1) 磁珠纯化法
按照磁珠说明书进行纯化操作。
(2) 柱纯化法
纯化前加入 80 μl Nuclease-Free Water 将产物稀释至 100 μl,再按纯化柱说明书进行纯化操作。
(3) 酚 / 氯仿纯化法
①向20 μl反应混合物中,加入115 μl Nuclease-Free Water 和15 μl 3 M 乙酸钠(pH5.2),混合均匀。
②加入等体积(150 μl)的酚/氯仿(1:1)混合液抽提一次,室温以最大转速(≥12000 rpm)离心5 min,将上层水相溶液转移至新的RNase-free EP管中。
注:转移上清时请勿吸到中间层。
③再加入等体积的氯仿抽提 2 次,收集上清,并转移至新的 RNase-free EP 管中。
④加入2倍体积的无水乙醇沉淀 RNA。混合均匀后置于-20℃至少 30 min,以最大转速(≥12000 rpm),4℃离心15 min,收集沉淀。
⑤加入500 μl冰预冷的70%乙醇洗涤RNA沉淀,以最大转速(≥12000 rpm), 4℃离心5 min ,收集沉淀。
⑥用20 μl Nuclease-Free Water 溶解RNA 沉淀。纯化后的RNA溶液于-80℃保存。
(4) 氯化锂沉淀法
(3)采用氯化锂沉淀法,RNA长度至少满足100 nt以上,且浓度不能低于100 ng/μl。
①向20 μl反应混合物中,加入30 μl Nuclease-Free Water 和30 μl 7.5 M氯化锂。
②混合均匀后,置于-20℃至少30 min,以最大转速(≥12000 rpm),4℃离心15 min,收集沉淀。
③加入500 μl冰预冷的70%乙醇洗涤RNA沉淀,以最大转速(≥12000 rpm), 4℃离心5 min ,收集沉淀。
④用20 μl Nuclease-Free Water 溶解RNA 沉淀。纯化后的RNA溶液于-80℃保存。
5. RNA 定量
(1) 紫外吸收法:游离的NTP等会严重影响定量的准确性,采用此方法 前请先进行RNA纯化。
(2) 染料法:可使用RNA特异荧光染料或相关试剂盒进行RNA定量,可 以对纯化或者未纯化的反应产物中的RNA进行定量。
6. RNA 检测
(1) 凝胶电泳法 为了评估转录本的长度及质量,转录产物应选择合适的非变性或变 性琼脂糖或聚丙烯酰胺凝胶上进行电泳检测。变性电泳下可减少RNA的 二级结构形成,通常RNA以正确大小的单个条带迁移。
转录长度 | 推荐使用电泳凝胶 |
>500 nt | 1%琼脂糖凝胶 |
100 nt<sample<500 nt | 2%琼脂糖凝胶或4-5%尿素变性聚丙烯酰胺凝胶 |
50 nt<sample<100 nt | 10%-15%尿素变性聚丙烯酰胺凝胶 |
<50nt | 20%尿素变性聚丙烯酰胺凝胶 |
(2) 毛细管电泳法 毛细管电泳法可数字化的精确评估RNA样本的完整性、纯度或降解 程度。与凝胶法相比,此法所需RNA样本量低,灵敏度高。
常见问题及解决办法
问题 | 产生问题的原因 | 解决问题的方法 |
转录产物产量低 | 实验模板中可能有抑制反应的组分或模板纯度较差或模板浓度不正确 | 若对照组产量正常,请重新纯化模板并确定模板浓度及其特异性。 若对照组产量低,请咨询本公司技术支持。 |
短片段转录产物产量低 | 转录起始片段短可能会抑制反应 | 转录产物100 nt时,建议延长反应时间或者增加模板量至2 μg |
RNA产物片段小于预期 | 模板序列中可能包含类似于T7 RNA聚合酶的终止序列 | 建议降低反应温度至30℃可能会增加全长转录本的比例,但是产量会下降。 |
可能模板中GC含量高或形成二级结构 | 建议提高反应温度至42℃或使用单链结合蛋白提高产量和长度。 | |
RNA产物片段大于预期 | 质粒模板DNA可能酶切不完全 | 建议质粒模板DNA继续进行酶切或者重新优化质粒模板DNA制备酶切反应体系。 |
RNA可能存在更强的二级结构而未完全变性 | 增加变性剂的浓度或加完RNA Loading Buffer后样品变性温度可提高至70℃。 |
